Desde la época de la los antiguos griegos, los científicos tenían asumido que la materia estaba compuesta por partículas diminutas que no se podían fraccionar más. El físico danés Niels Bohr manifestó un modelo nuevo para explicar cómo es la estructura del átomo y la manera de comportarse, un hecho que le llevó a ganarse el Premio Nobel de Física en 1922.
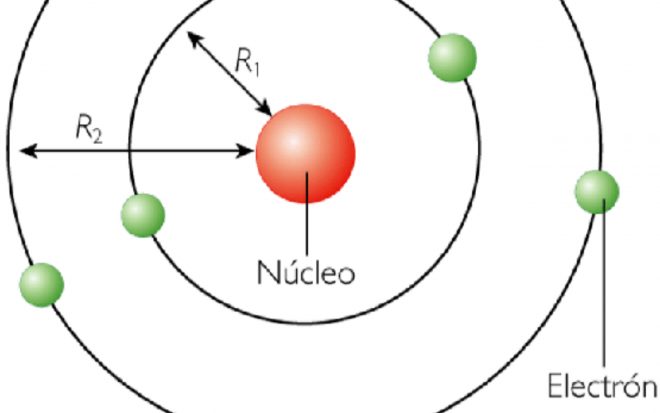
Un modelo en el que los electrones circulan a una cierta distancia del núcleo y eso depende de la energía. Un dato interesante es que el átomo más simple es el hidrógeno, el cual orbita un electrón y eso lleva a tener menos energía.
¿Te apetece descubrir las características del modelo atómico de Bohr?
Se apoya en otras teorías
El modelo atómico de Bohr se apoyó desde el punto de vista del concepto en el modelo atómico de Rutherford y en las ideas respecto a la cuantización de Max Planck, lo que conlleva a situarlo entre la mecánica clásica y la mecánica cuántica. También tuvo en cuenta las ideas del efecto fotoeléctrico (la transmisión de electrones por un objeto al recaer sobre él una radiación electromagnética) originario de Albert Einstein, un físico con quien compartía amistad.
Evidencia experimental
Según este modelo, los átomos sorben y propagan una radiación cuando los electrones van de una órbita a otra. Un hecho por el que dos físicos alemanes llamados Gustav Hertz y James Franck lograron la evidencia experimental de este estado en 1914.
Número de electrones en cada capa
Cada capa solo permite la entrada de un número determinado de electrones, teniendo en cuenta que en las primeras cuatro capas los electrones pueden ser 2, 8, 18 y 32. La tabla periódica está compuesta por multitud de elementos y aquellos que están en la misma columna tienen los mismos electrones en la última capa.
Sin energía no hay movimiento del electrón
El modelo atómico de Bohr expresa que si no hay un mínimo de energía el electrón no tiene la capacidad de moverse de una capa a otra. Niels afirmó que el término “quantum o cuanto” es el valor mínimo de energía que puede tomar un electrón para ir de un nivel a otro. También manifestó que el “estado fundamental” es el nivel de energía más bajo mientras que el “estado excitado” es el de mayor energía pero con más inestabilidad.
Saltos cuánticos
- Absorción de energía: cuando un electrón pasa de una capa más interna a una más externa.
- Emisión de energía: cuando un electrón pasa de un nivel más externo a uno más interno.
Los saltos cuánticos surgen de manera natural y sin que el electrón pase por ninguna órbita intermedia.
Postulados de Bohr
Los 4 principios del modelo atómico de Bohr:
- Expresión numérica de la energía atómica ya que cada electrón tiene una energía específica.
- Los estados estacionarios son los electrones que conforman una órbita.
- El nivel de energía asciende cuando hay más consumo y disminuye cuando hay menos.
- Las capas electrónicas tienen un número específico de electrones y se asignan por K, L, M, N, O, P, Q.